エレンタール配合内用剤は、消化のほとんど必要としない成分で構成された、日本初の成分栄養剤です。
5つのポイント
Point 1 窒素源はアミノ酸で構成され易吸収性です(ラット)
タンパク質の消化過程が不要で吸収性に優れています。また、腸管のエネルギー源であるグルタミンを配合しています。
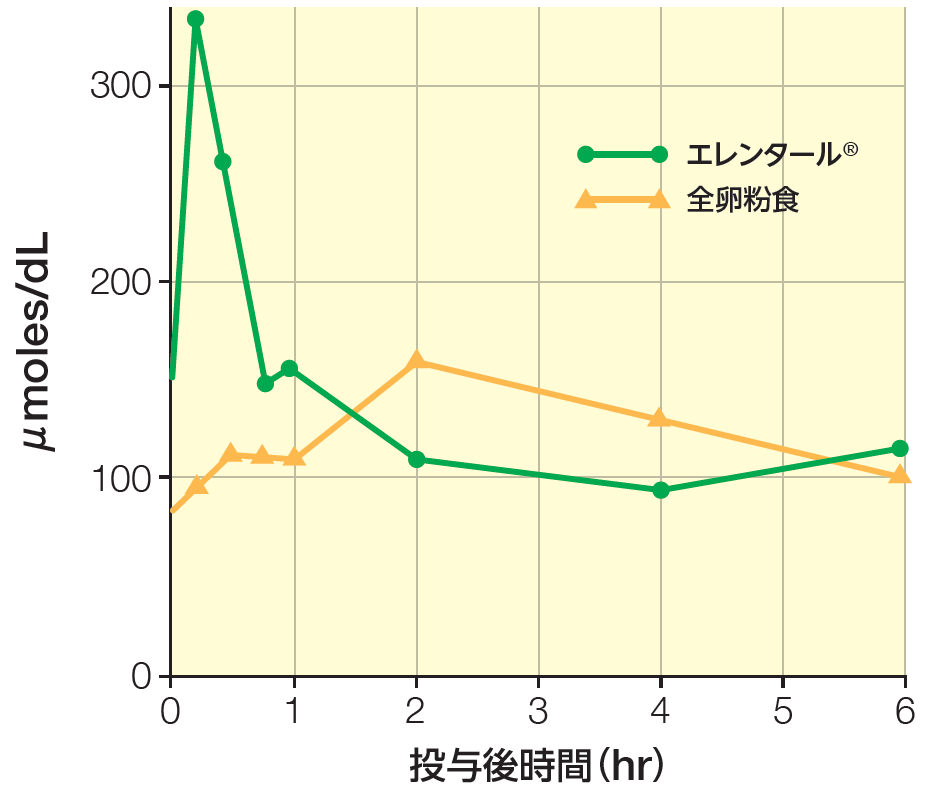
肝門脈血中の必須アミノ酸濃度
試験方法:
市販飼料CE-7及び水を自由摂取させ、6週齢のFischer系ラットを6日間予備飼育した。予備飼育終了日の午前9時から午後7時まで絶食した後、15g/kg体重に相当する量で胃ゾンデを用い、エレンタール®を単回投与した。対照は全卵粉食*とした。1時点につき5匹ずつ使用した。
*全卵粉食
(脂肪、セルロース、デキストリン、ビタミン、ミネラル、全卵、塩化コリン)
結果:
肝門脈血中の必須アミノ酸濃度(合計値)を示す。エレンタール®投与群は投与後15分に最大値を示したのに対し、全卵粉食投与群では投与後2時間に最大値を示した。
中辻博尊 他:薬理と治療 7(11), 103-111, 1979
※著者は味の素株式会社の社員である。
Point 2 脂質含有量を低く抑えています
平成29年国民健康・栄養調査結果より、エネルギー摂取量に占める脂質摂取量の割合(脂肪エネルギー比率)は、年齢によって違いはあるものの23.4%~30.5%でした。エレンタール®が含有している脂質、糖質、タンパク質のエネルギー比率は以下の通りです。
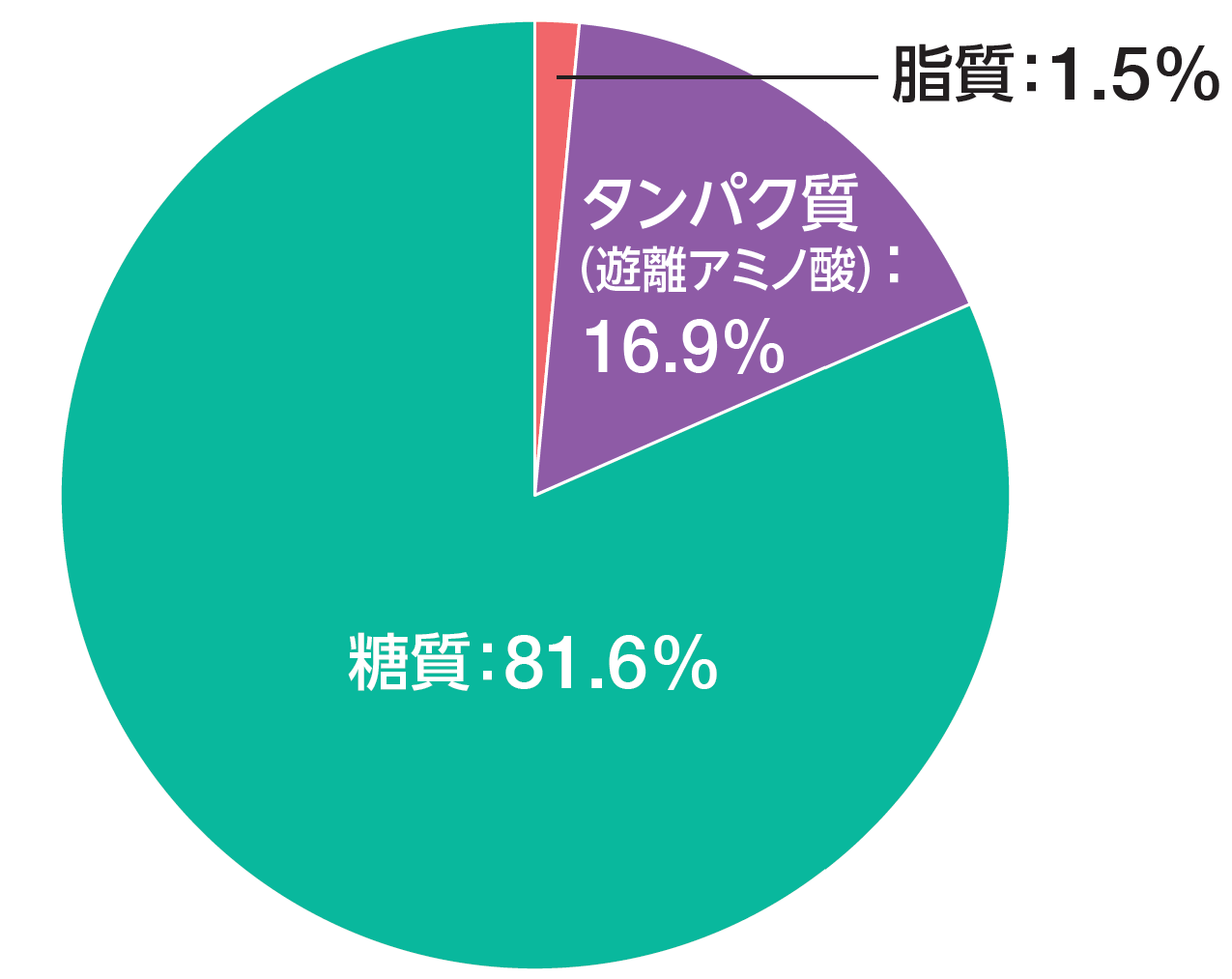
エレンタール®(80g当たり)の脂質、糖質、タンパク質(遊離アミノ酸)のエネルギー比率
石渡一夫編:静脈経腸栄養年鑑 2020-21,
株式会社ジェフコーポレーション, 2020:p.90-91より作図
また、エレンタール®及び国内で販売されている他社の医薬品扱いの経腸栄養剤の脂質含有量、脂質のエネルギー比率は以下の通りです。
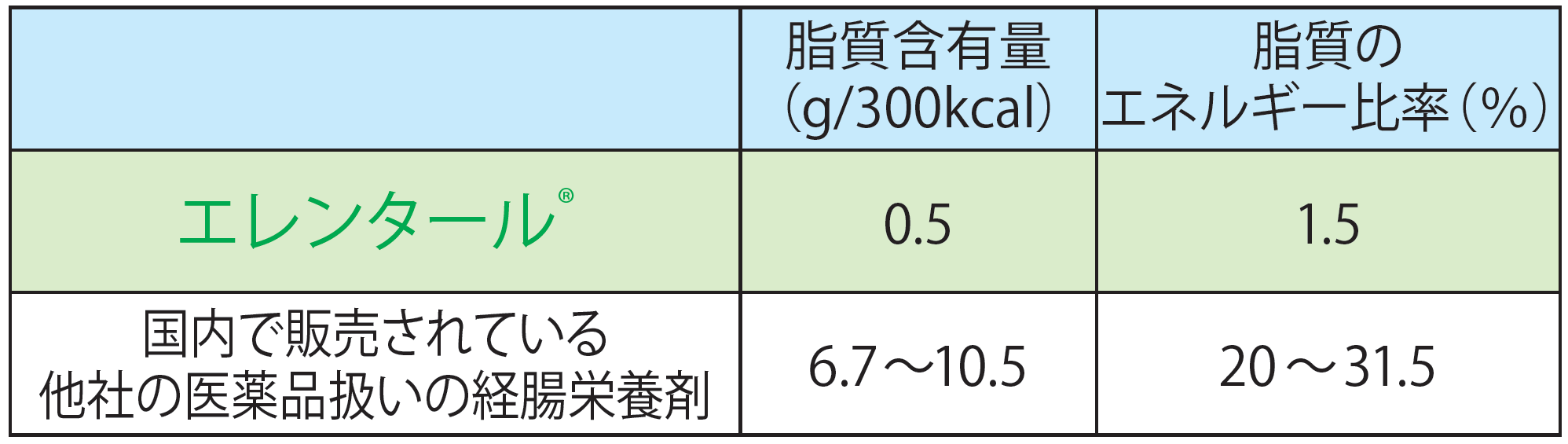
石渡一夫編:静脈経腸栄養年鑑 2020-21,
株式会社ジェフコーポレーション, 2020:p.90-91より作表
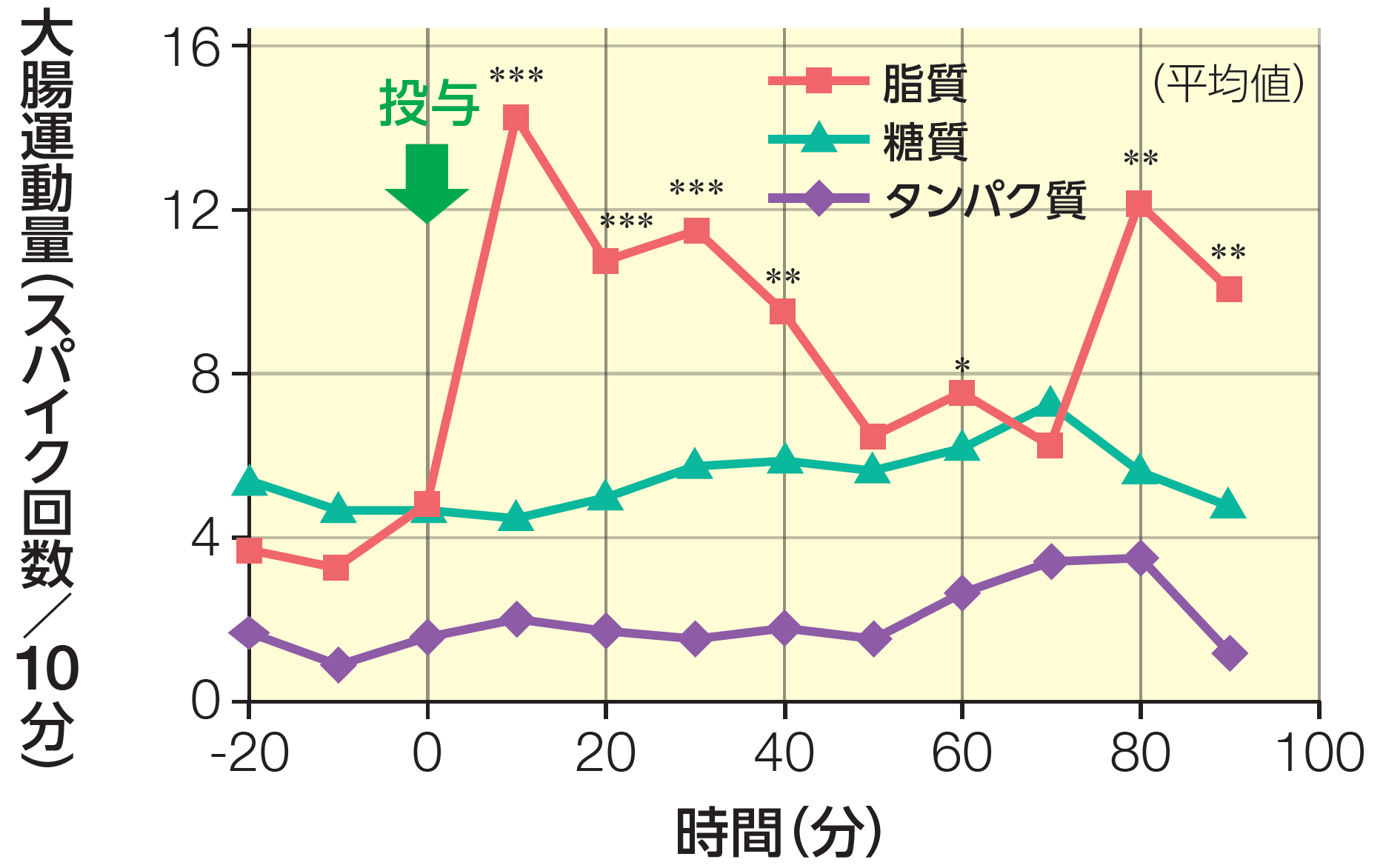
対応のあるt検定(投与前との比較)
Wright SH et al.:Am. J. Physiol, 238(3):G228-32,1980より改変
腸管運動に対する栄養素の影響(健康成人)〈海外データ〉
試験方法:
健康成人7名に脂質600kcal、糖質320kcal、タンパク質200kcalを投与し、活動電位の発生数を指標として、大腸の運動量を経時的に測定した。
結果:
糖質やタンパク質を投与しても運動量こほとんど変化はないが、脂質の投与により腸筐の運動量は有意(対応のあるt検定、投与後70分以外はp<0.05)に冗進した。
Point 3 低残渣です
低残渣で糞便量が減少しました(ラット)。
中辻博尊 他:薬理と治療 7(11), 11-22, 1979 ※著者は味の素株式会社の社員である。
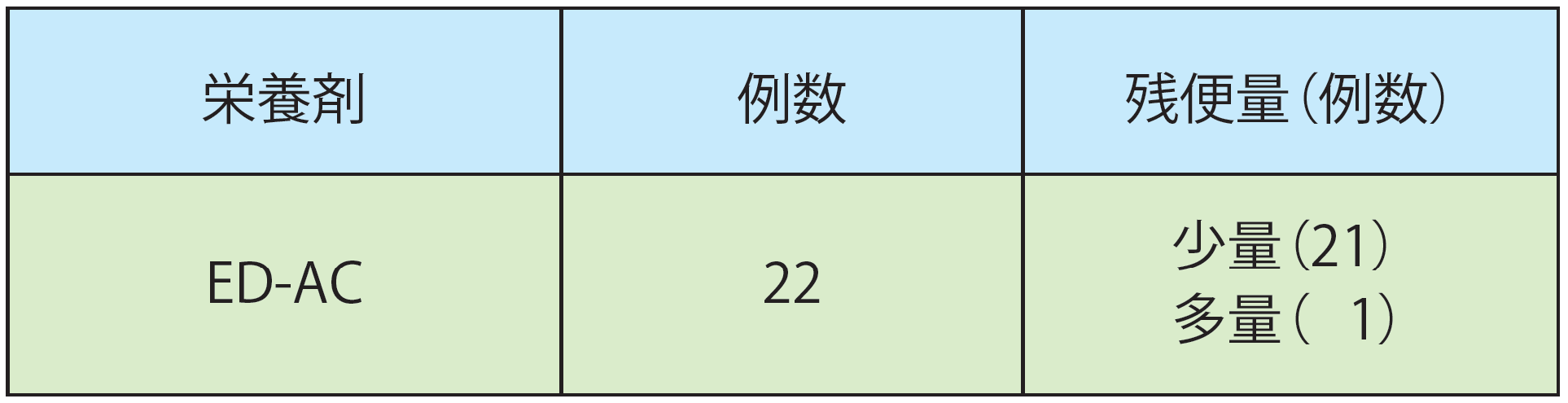
エレンタール®(ED-AC)による開腹時残便量への影響
試験方法:
大腸手術前処置として、エレンタール®(ED-AC)をおよそ2000kcal/日で5~7日摂取した22例について、開腹時残便量を評価した。
結果:
22例中1例(4.5%)は、癌腫による閉塞が強固なため多量の泥状便が残存していたが、21例(95.5%)は大腸内にほとんど糞便を認めなかった。
相場哲朗 他:臨床外科 35(12) p.1734-1740, 1980
Point 4 5Frチューブにおいても流動性が認められました
エレンタール®の流動性試験より以下の結果が得られ、5Frチューブにおいても流動性が認められました。
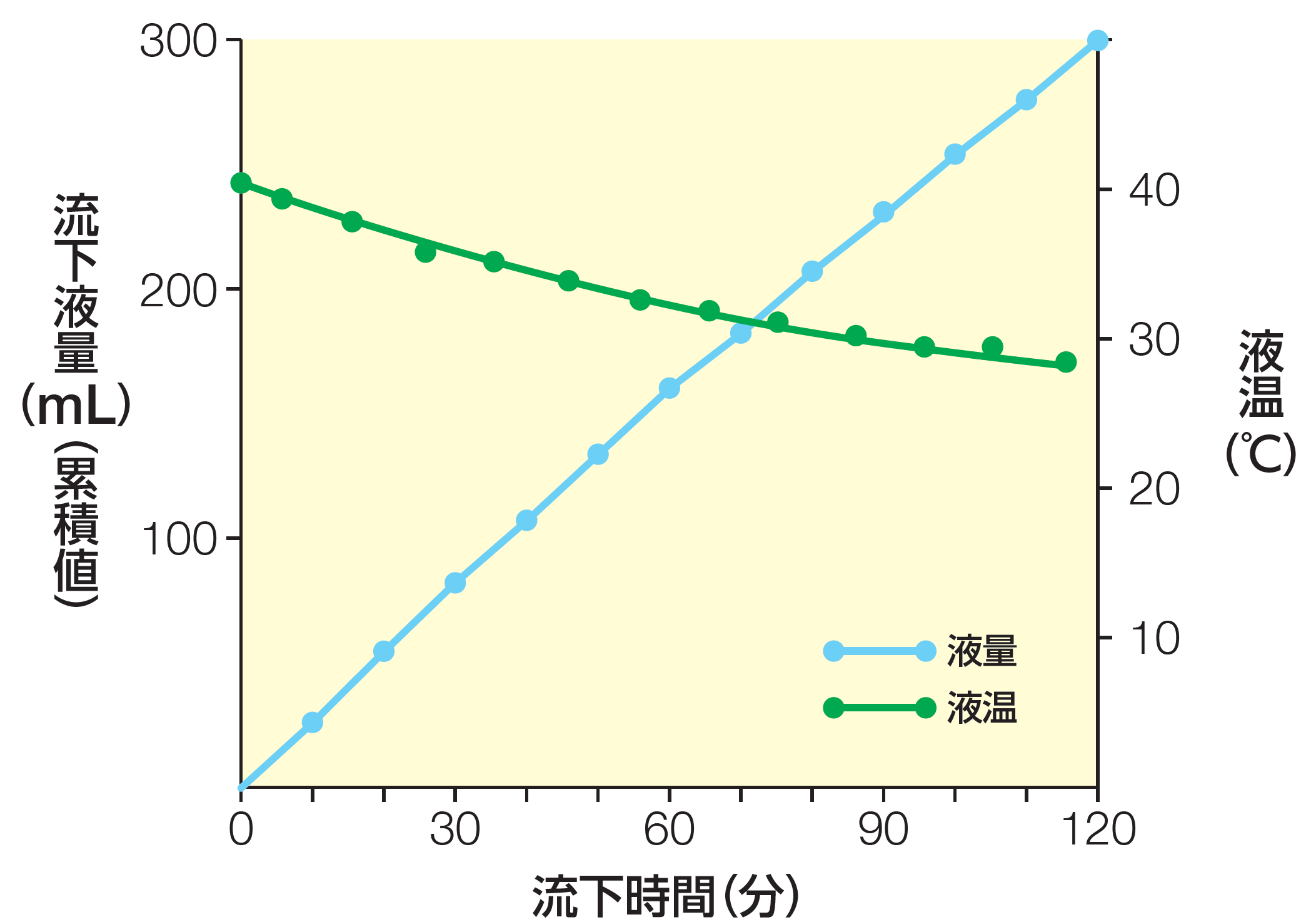
エレンタール®流動性試験(5Frチューブの場合)
試験方法:
エレンタール®を最終濃度1kcal/mLになるよう微温湯(約35℃)に溶解させ、全量300mLとしてEDバックに入れた。液温が30℃になったら、クランプを全開させ5Frの投与チューブ120cmの中を通過させ、落差70cmのところまで滴下させた。その排液量と液温を30分毎に測定した。投与チューブを変え、同じ試験を3回繰り返した。
結果:
3回の試験結果の平均値を左図に示した。
EAファーマ株式会社社内資料(エレンタール®流動性試験)
Point 5 安全性は以下のとおりです
重大な副作用として、ショック、アナフィラキシー(頻度不明)、低血糖(0.1%未満)が報告されています。
副作用発現率は17.50%(1,430例/8,170例)でした。主な副作用は下痢12.94%(1,057件)、腹部膨満感4.39%(359件)、血中AST(GOT)・ALT(GPT)・Al-P上昇3.68%(301件)、悪心2.06%(168件)、嘔吐1.64%(134件)、腹痛1.51%(123件)等でした(再審査終了時)。
安全性情報の詳細は、インタビューフォームの副作用をご参照ください。
エレンタールⓇ配合内用剤インタビューフォーム2025年4月改訂(第10版)