【レケンビ】2025年6月13日締め 副作用件数一覧
最新のお知らせ
-
2025.6.23
- 副作用情報
- 脳神経・精神
- レケンビ
-
2025.6.23
- 副作用情報
- 脳神経・精神
- レケンビ
【レケンビ】2025年6月13日締め 重篤副作用一覧
-
2025.6.16
- 副作用情報
- オンコロジー
- ハラヴェン
【ハラヴェン】2025年5月30日締め 重篤副作用一覧
-
2025.6.2
- 安全性・適正使用
- オンコロジー
- レンビマ
レンビマカプセル4mg、レンビマカプセル10mg 使用上の注意改訂のお知らせ
-
2025.6.2
- 安全性・適正使用
- 脳神経・精神
- レケンビ
レケンビ:適正使用のお願い
-
2025.5.20
- 安全性に関する情報
- オンコロジー
- ギリアデル
ギリアデル適正使用ガイド(2025年4月作成)
-
2025.6.23
- 副作用情報
- 脳神経・精神
- レケンビ
【レケンビ】2025年6月13日締め 副作用件数一覧
-
2025.6.23
- 副作用情報
- 脳神経・精神
- レケンビ
【レケンビ】2025年6月13日締め 重篤副作用一覧
-
2025.6.16
- 副作用情報
- オンコロジー
- ハラヴェン
【ハラヴェン】2025年5月30日締め 重篤副作用一覧
指導箋
認知症に関する指導箋
-
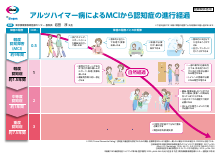
アルツハイマー病によるMCIから認知症の進行経過(LEQ1122)
-
会員限定 “もの忘れ” が 気になる方とそのご家族へ(LEQ1007)

-
会員限定 知っておきたい脳の健康(LEQ1003)

-
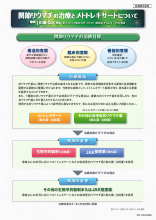
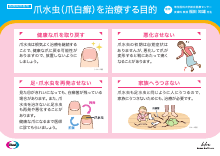
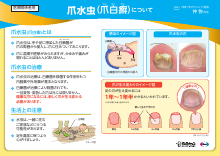
レケンビの治療を受ける可能性がある方へ レケンビによる治療について(LEQ1065)

-
見逃さないで、MCI(軽度認知障害)(LEQ1085)

-
週に何回外出していますか?外出がもたらす心身の健康(LEQ1051)

-
レケンビの治療を受ける可能性がある方へ 患者さん説明用ガイドブック(LEQ1062)

-
会員限定 認知症および軽度認知障害(MCI)診断のためにアミロイドPET検査をお受けになる方へ(LEQ1040)
-
レケンビ®の治療を始める方とそのご家族へ(LEQ1008)

-
認知症および軽度認知障害(MCI)の診断のためにCSF(脳脊髄液)検査をお受けになる方へ(LEQ1032)

-
認知症および軽度認知障害(MCI)の診断のためにCSF検査をお受けになる方へ(LEQ1029)

-
アリセプトを飲まれる方へ(レビー小体型認知症の方向け)(ART1749)

-
アリセプトを飲まれる方へ_アルツハイマー型認知症の方(ART1273)

不眠に関する指導箋
-
(高齢者版)良い眠りのためのポイント(DVG1095)

-
(こども版)良い眠りのためのポイント(DVG1096)

-
(成人版)良い眠りのためのポイント(DVG1094)

-
サイレース錠を服用される方へ(SIL1003)

-
女性の抱える睡眠の悩み 女性に特有の健康課題(DVG1076)

-
あなたの睡眠薬を見直してみませんか?(JB1344)

-
睡眠スケジュール表(DVG1042)

-
睡眠薬を飲み始めるあなたに(DVG1068)

-
眠りの状態チェックシート(アテネ不眠尺度)(DVG1061)

-
あなたの眠りセルフチェック(アテネ不眠症尺度 ビンゴ型)(DVG1060)

-
ルネスタを服用される方へ(PDF版のみ)*裏面に苦味への対処あり(LUN1185)
-
デエビゴ®錠を服用される患者さんへ(DVG1022)

-
あなたにあった不眠症の治療を一緒に考えましょう(DVG1044)

-
眠りのための12ポイント(DVG1040)

-
「眠り」のお悩みありませんか?(DVG1035)

-
眠りのための注意点(体内時計・生活習慣指導資材)(DVG1025)

-
睡眠薬を見直してみませんか?(DVG1031)

-
デエビゴ®錠を服用される患者さんへ(DVG1016)

-
不眠でなやむあなたに(LUN1173)

てんかんに関する指導箋
パーキンソン病に関する指導箋
-
私の症状ノート(ピクトグラム編)(EQF1052)

-
パーキンソン病患者さんのための運動継続プログラム:シリーズ3.飲み込みについて(EQF1046)

-
パーキンソン病患者さんのための運動継続プログラム:シリーズ2. 歩行が気になる(EQF1045)

-
ウェアリングオフチェックシート(EQF1038BKA)

-
パーキンソン病患者さんのための運動継続プログラム:シリーズ1. 姿勢が気になる(EQF1030)

-
パーキンソン病患者さんのためのリハビリテーションー知ってためになるリハビリテーションの大切さ(EQF1029)

-
お薬を飲んだのに、しばらくすると症状が出てしまう~パーキンソン病とウェアリングオフ現象(EQF1025)

-
エクフィナR錠を服用する方とそのご家族へ(EQF1018)