-
脳神経・精神領域
パーキンソン病
パーキンソン病とは
パーキンソン病は、振戦、筋強剛、運動緩慢、姿勢反射障害を主症状とし、病理学的には黒質ドパミン神経細胞の脱落とレビー小体の出現を特徴とする神経変性疾患である1)。
加齢が発症に寄与することが知られており、超高齢社会において、パーキンソン病の発症者はますます増加すると予想されている。
パーキンソン病の病因、病態ならびに治療について、これまでも様々な知見が積み上げられてきたが、今なお、疾患の概念や治療が進化し続けている領域である。
病態と病理
パーキンソン病の病態の中心は、下図に示した、中脳黒質のドパミン神経細胞の脱落変性、およびレビー小体の発現である1)。
病理においては、
マクロ的には、脳の中脳黒質、橋青斑核のメラニン含有細胞の減少による脱色素所見、ミクロ的には、中脳黒質、橋青斑核、延髄迷走神経背側核の変性が認められる2)。
また、レビー小体と呼ばれるαシヌクレインを主体とする好酸性神経細胞封入体が、神経変性を起こす脳幹部だけでなく、大脳辺縁系、大脳新皮質にも存在することが分かっている3)。
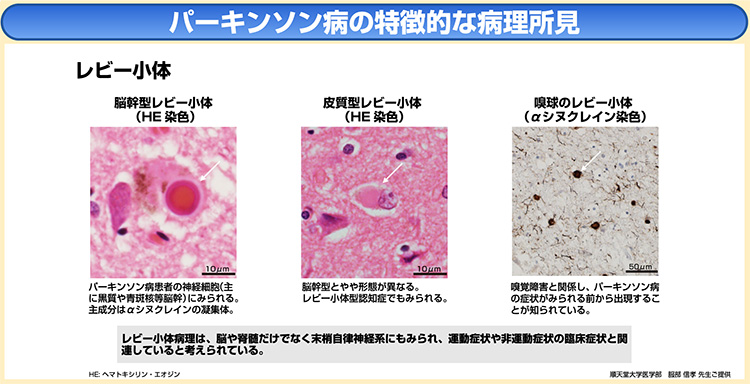
また、これらの病理変化を背景とする神経変性の部位により、出現する症状が異なることも指摘されている。
中脳黒質の線条体黒質系の障害により、運動障害(パーキンソニズム)が、青斑核の障害により、気分障害や睡眠障害が、延髄迷走神経背側核の障害により、消化管運動障害が生じると報告されている2)。
特に中脳黒質変性で生じるパーキンソニズムはパーキンソン病の本態であり、治療の中核的なターゲットとなっている。
病因
孤発性が9割を占め、家族内発症が存在する遺伝性パーキンソン病は5~10%と報告されている1)。
これまで疫学調査の結果から、除草剤や殺虫剤などの農薬への暴露、乳製品摂取、頭部損傷の既往などの環境因子が発症に寄与が示唆されている4)が、発症の原因については未だ完全には解明されていない。
疫学
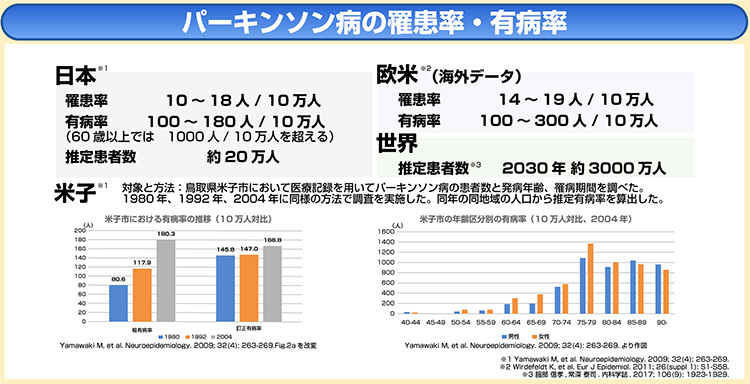
有病率は、高齢になるほど高くなる。
欧米の報告では、60歳以降に有病率・罹患率ともに急増し、80歳以降がピークとされ5)、我が国の住民コホート調査でも欧米と同様の傾向が示されている6)。
罹患率は欧米の報告において、10万人あたり14~19人、有病率は10万人あたり100~300人と報告されている5)。
我が国の罹患率は、10万人あたり10~18人、有病率は10万人あたり100~180人と報告されている6)。
我が国の年齢・性差を補正した有病率は10万人あたり166.8人と推定され6)、この数値を基にした、パーキンソン病患者数は20万人程度と推定されている。
症状と経過
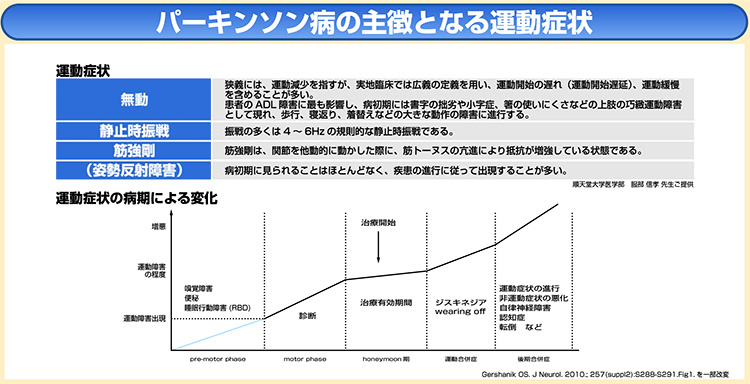
パーキンソン病では、主徴となる「無動」を必須とし、それに加えて「静止時振戦」か「筋強剛」のどちらか1つか、または両方存在する場合にパーキンソニズムを疑う。
従前は「姿勢反射障害」も含めて四大運動症状とされていたが、姿勢反射障害は病初期の出現は少ないことから、診断に必要な症状から除外された。
発症後の経過は、運動障害発現後の5年間程度、運動症状がドパミン補充療法によく反応する、通称「ハネムーン期」を経て、その後、L-ドパの治療反応性が低下しウェアリングオフ、ジスキネジアなどが出現する。
さらに進行すると、認知機能障害、幻覚、妄想が顕在化し、運動障害の重症化と相まって自立した生活が困難になる。
60歳で発症した患者さんが自立した生活を送れる期間は、平均15年程度と報告されているが、個人差が大きい7)。
一方で若年発症者は、自活期間が長くなることが知られている。
多様な非運動症状
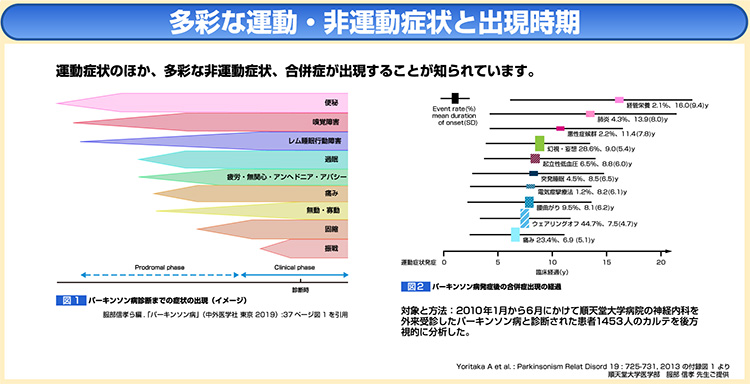
疾患特徴的な運動症状に加え、近年、注視されているのがパーキンソン病に伴う多様な非運動症状である。
運動症状の出現前から、便秘、嗅覚障害、レム睡眠行動障害などを生じることが多く、パーキンソン病の先行症状としても研究が行われている8)。
運動症状発症後も、便秘、日中の過眠、易疲労性、睡眠障害、不安感などの気分障害を合併することが臨床的にもよく知られている9)。
パーキンソン病の治療においては、主体となる運動症状とともに、生活の質と密接につながる非運動症状にも目を向け、適切な治療を行うことが重要である。
【参照文献】
1)日本神経学会監修. 「パーキンソン病診療ガイドライン」作成委員会編. 「パーキンソン病診療ガイドライン2018」. 医学書院, 東京, 2018.
2)服部信孝ら編. 「パーキンソン病」. 中外医学社, 東京, 2019.30-35.
3)Braak H, et al. Neurobilo Aging. 2003; 24: 197-211.
4)Noyce AJ, et al. Ann Neurol. 2012; 72(6): 893-901.
5)Wirdefeldt K, et al. Eur J Epidemiol. 2011; 26(suppl 1): S1-S58.
6)Yamawaki M, et al. Neuroepidemiology. 2009; 32(4): 263-269.
7)柏原建一. 神経治療. 2016: 33; 313-317.
8)Gershanik OS. J Neurol. 2010.; 257(suppl2): S288-S291.
9)Maeda T, et al. Parkinsonism Relate Disord. 2017. 38: 54-60.
診断・治療
診断基準とポイント
病理学的に中脳腹側に位置する黒質緻密部のメラニン含有ドパミン細胞にレビー小体を確認することで確定診断となるが、実臨床では、臨床診断基準に則って診断する。

2015年に提唱されたMDS(International Parkinson and Movement Disorder Society)のPD診断基準10)は、「パーキンソニズムの定義」、「支持的基準」、「絶対除外基準」、「red flag」(相対的除外基準)の4つのパートから構成されている。
各パートの項目への適合をチェックした上で、「clinically established PD」、「clinically probable PD」、または、「パーキンソン病とは診断できない対象群」に整理していくフローをとっている。
また、MDSの診断基準では、神経画像検査が重要な診断ツールとして位置づけられたことが大きな特徴である。
典型的なMRI画像所見
診断上、重要な神経画像検査の典型画像を供覧する。
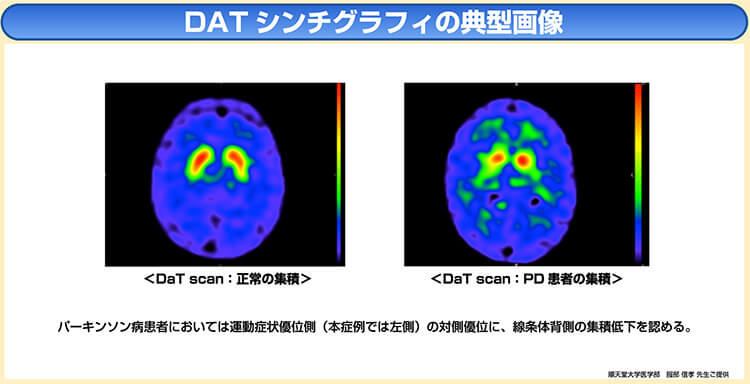
◆ドパミン神経系イメージング(DATシンチグラフィ)
DATシンチグラフィ検査は、脳内の線条体におけるドパミントランスポーター(DAT)の分布を可視化することで診断精度の向上につなげている。
ドパミン神経の変性・脱落が見られるパーキンソン病をはじめとするパーキンソン症候群では、ドパミン神経の減少とともに、DATが減少することが分かっている。
下図のように、運動症状優位側の対側優位に線条体背側のDATの集積低下を認める画像所見が、パーキンソン病患者に特徴的とされている11)12)。
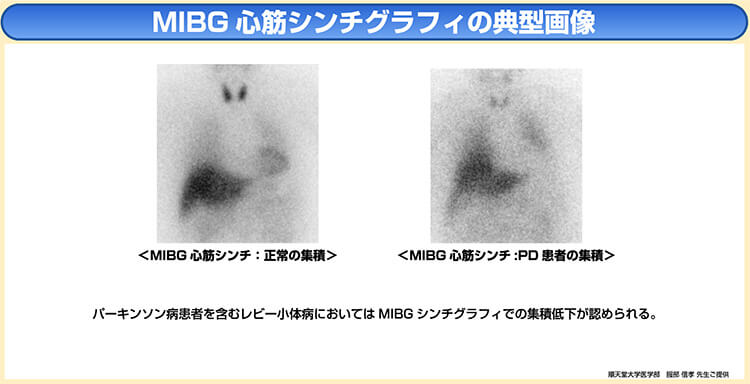
◆MIBG心筋シンチグラフィ
MIBG心筋シンチグラフィは、心臓交感神経の障害を評価するための核医学検査である。
パーキンソン病をはじめとするレビー小体関連疾患では、下図のように心筋のMIBG集積が高率に低下することが知られている11)12)。
治療の原則
パーキンソン病の進行を抑制する神経保護治療はなく、対症療法が中心である。
対症療法には、L-ドパ含有製剤を中心とする薬物療法、
脳深部刺激療法を中心とする機器装着療法、
カウンセリング、リハビリテーションなどの非薬物療法
――などの選択肢が存在する。
臨床において、複数の治療法を組み合わせて適用することが多く、治療の選択肢は複雑化している。
薬物療法
パーキンソン病治療薬として承認を受けている薬剤を紹介する。
治療の中心となる、ドパミンの前駆物質を補充するL-ドパ含有製剤、ドパミンの作用を補充するドパミン受容体刺激薬、
脳内でのドパミンの分解や、血液中でのL-ドパの分解を防ぎ、効果を延長する薬剤、ドパミンの活動に関係する神経活動を調整する薬剤
――など、多彩なアプローチの薬剤が登場している13)。

こうした薬剤の使い分けについて、我が国の「パーキンソン病診療ガイドライン2018」11)では、早期パーキンソン病治療についての推奨を示している。
下図のように、「早期パーキンソン病治療はL-ドパとL-ドパ以外の薬物、ドパミンアゴニストおよびMAOB阻害薬、どちらで開始すべきか」という問いに対して、「運動障害により生活に支障をきたす場合、早期パーキンソン病の治療はL-ドパで開始することを提案する」と明記している。

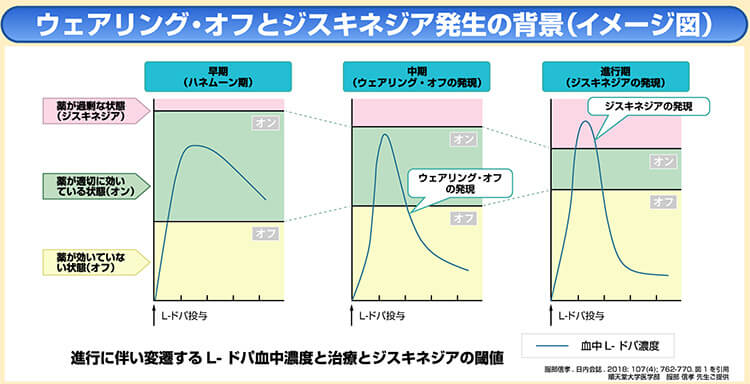
パーキンソン病が進行すると、薬が効く時間が短くなり、薬の効果が切れて運動症状などの症状が出現する「ウェアリングオフ現象」が生じることがある。
治療開始後、約5年で50%程度の患者さんにウェアリングオフ現象などの運動合併症が生じたと報告されている14)。
一方で、薬を飲んで一番効果が現れている時期にジスキネジアを生じるピークドーズ・ジスキネジアが出現することも知られている。
こうした現象は下図13)のように、L-ドパ含有製剤の血中濃度の急激な変化から生じると考えられており、薬剤量や頻度、組み合わせなどを個別に調整することになる。
ウェアリングオフを呈する進行期の治療アルゴリズム11)は「パーキンソン病診療ガイドライン2018」にまとめられている。
下図のように、L-ドパ含有製剤の頻回処方や、併用抗パーキンソン病薬の追加・増量などを検討するアルゴリズムである。
その上で、薬物療法が困難な場合は脳深部刺激療法を考慮することになる

パーキンソン病については現在、レビー小体関連疾患という大きなカテゴリーで、その病態の検討や、早期治療に向けたバイオマーカーの研究、iPS細胞を用いた新たな細胞移植療法の検討が進められている。
今後の新たな治療への期待も大きいが、まずは基本から、しっかりと押さえてもらいたい。本稿を臨床現場でのパーキンソン病診療に役立てていただければ、幸いである。
【参照文献】
10)Postuma RB, et al. Mov Disord. 2015; 30(12): 1591-1601.
11)日本神経学会監修. 「パーキンソン病診療ガイドライン」作成委員会編. 「パーキンソン病診療ガイドライン2018」. 医学書院, 東京, 2018.
12)服部信孝ら編. 「パーキンソン病」. 中外医学社, 東京, 2019.80-88.
13)服部信孝. 日内会誌. 2018; 107: 762-770.
14)Yoritaka A. et al. Parkinsonism and Related Disord. 2013; 19: 725-731.
